Jak fungují a fungují baterie
 V nejširším slova smyslu v technice se pod pojmem "baterie" rozumí zařízení, které umožňuje za určitých provozních podmínek akumulovat určitý druh energie a v jiných jej využívat pro lidské potřeby.
V nejširším slova smyslu v technice se pod pojmem "baterie" rozumí zařízení, které umožňuje za určitých provozních podmínek akumulovat určitý druh energie a v jiných jej využívat pro lidské potřeby.
Používají se tam, kde je potřeba energii po určitou dobu sbírat a následně ji využít k provádění velkých pracně náročných procesů. Například hydraulické akumulátory používané v plavebních komorách umožňují lodím vystoupat na novou úroveň koryta řeky.
Elektrické baterie pracují s elektřinou na stejném principu: nejprve akumulují (akumulují) elektřinu z externího nabíjecího zdroje a poté ji dávají připojeným spotřebitelům k práci. Svým charakterem patří k chemickým zdrojům proudu schopným provádět periodické cykly vybíjení a nabíjení opakovaně.
Během provozu neustále probíhají chemické reakce mezi součástmi elektrodových desek s jejich náplňovou látkou - elektrolytem.
Schematický diagram bateriového zařízení může být reprezentován zjednodušeným výkresem, když jsou do těla nádoby vloženy dvě desky z různých kovů s dráty pro zajištění elektrických kontaktů. Mezi desky se nalije elektrolyt.
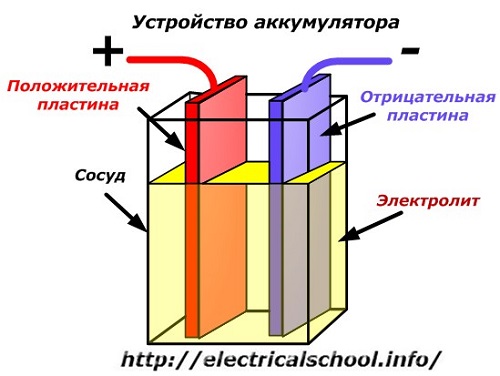
Provoz na baterie při vybití
Když se k elektrodám připojí zátěž, např. žárovka, vznikne uzavřený elektrický obvod, kterým protéká výbojový proud. Vzniká pohybem elektronů v kovových částech a aniontů s kationty v elektrolytu.
Tento proces je obvykle znázorněn na diagramu s konstrukcí nikl-kadmiové elektrody.
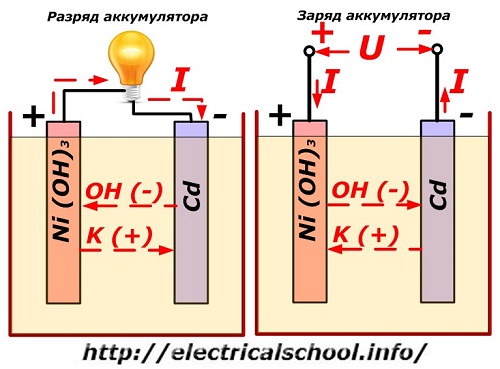
Zde se jako materiál kladné elektrody používají oxidy niklu s přísadami grafitu, které zvyšují elektrickou vodivost. Kovem záporné elektrody je houbovité kadmium.
Při výboji jsou částice aktivního kyslíku z oxidů niklu uvolňovány do elektrolytu a směrovány na záporné desky, kde dochází k oxidaci kadmia.
Výkon baterie při nabíjení
Když je zátěž vypnutá, na svorky desky je přivedeno konstantní (v určitých situacích pulzující) napětí o větší hodnotě než u nabité baterie stejné polarity, když se svorky plus a minus zdroje a spotřebiče shodují. .
Nabíječka má vždy větší výkon, který „potlačuje“ zbytkovou energii v baterii a vytváří elektrický proud v opačném směru vybíjení. V důsledku toho se mění vnitřní chemické procesy mezi elektrodami a elektrolytem. Například na krabici nikl-kadmiových desek je pozitivní elektroda obohacena kyslíkem a negativní - do stavu čistého kadmia.
Při vybití a nabití baterie se mění chemické složení materiálu desek (elektrod), ale nemění se elektrolyt.
Způsoby připojení baterie
Paralelní připojení
Velikost vybíjecího proudu, kterou člověk snese, závisí na mnoha faktorech, především však na konstrukci, použitých materiálech a jejich rozměrech. Čím větší je plocha desek u elektrod, tím větší proud mohou odolat.
Tento princip se používá pro paralelní zapojení článků stejného typu v bateriích, když je potřeba zvýšit proud do zátěže, ale pro nabíjení takového provedení bude nutné zvýšit výkon zdroje. Tato metoda se zřídka používá pro hotové konstrukce, protože nyní je mnohem snazší okamžitě zakoupit potřebnou baterii. Ale výrobci kyselinových baterií to používají, spojují různé desky do jednotlivých bloků.
Sériové připojení
V závislosti na použitých materiálech může být mezi dvěma elektrodovými deskami baterií běžnými v každodenním životě generováno napětí 1,2 / 1,5 nebo 2,0 voltů. (Ve skutečnosti je tento rozsah mnohem širší.) Je zřejmé, že pro mnoho elektrických zařízení nestačí. Proto se baterie stejného typu zapojují do série a často se tak děje v jednom případě.
Příkladem takové konstrukce je široce rozšířený automobilový vývoj založený na kyselině sírové a olověných elektrodových deskách.
Obvykle mezi lidmi, zejména mezi řidiči dopravy, je obvyklé nazývat jakékoli zařízení baterií, bez ohledu na počet jeho základních prvků - krabic. To však není úplně správné.Konstrukce, sestavená z několika krabic zapojených do série, je již baterií, pro kterou je připojen zkrácený název «АКБ»... Její vnitřní struktura je znázorněna na obrázku.
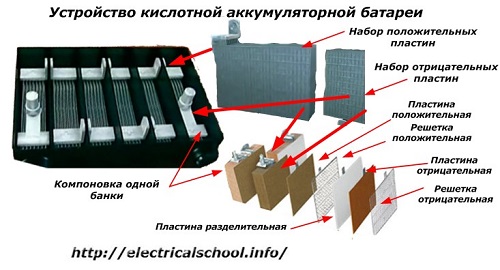
Každá z nádob se skládá ze dvou bloků se sadou desek pro kladné a záporné elektrody. Bloky do sebe zapadají bez kovového kontaktu s možností spolehlivého galvanického spojení přes elektrolyt.
V tomto případě mají kontaktní desky přídavnou mřížku a jsou od sebe odděleny oddělovací deskou.
Spojení desek v blocích zvětšuje jejich pracovní plochu, snižuje celkový odpor celé konstrukce a umožňuje zvýšit výkon připojené zátěže.
Na vnější straně krabice má taková baterie prvky znázorněné na obrázku níže.
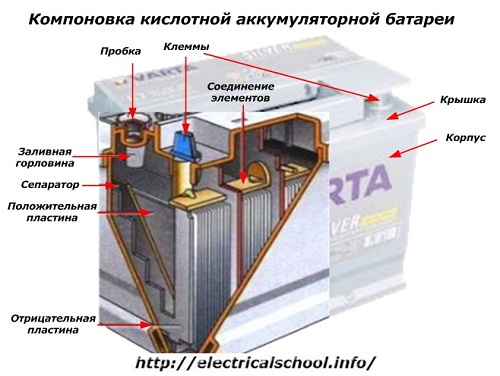
Ukazuje, že robustní plastové pouzdro je utěsněno krytem a nahoře je vybaveno dvěma svorkami (obvykle kuželovitého tvaru) pro připojení k elektrickému obvodu automobilu. Na jejich svorkách jsou vyraženy značky polarity: «+» a «-«. Obvykle má kladná svorka o něco větší průměr než záporná svorka, aby se blokovaly chyby v zapojení.
Provozuschopné baterie mají v horní části každé nádoby plnicí otvor pro kontrolu hladiny elektrolytu nebo přidání destilované vody během provozu. Je do něj našroubována zátka, která chrání vnitřní dutiny pouzdra před znečištěním a zároveň zabraňuje rozlití elektrolytu při naklonění baterie.
Vzhledem k tomu, že při silném nabíjení je možné plynování z elektrolytu (a tento proces je možný při intenzivní jízdě), jsou v zátkách vytvořeny otvory, aby se zabránilo zvýšení tlaku uvnitř krabice.Přes ně vystupuje kyslík a vodík, stejně jako páry elektrolytů. Doporučuje se vyhnout se takovým situacím, které zahrnují nadměrné nabíjecí proudy.
Stejný obrázek ukazuje spojení prvků mezi bankami a uspořádání elektrodových desek.
Autostartovací baterie (olověná kyselina) fungují na principu dvojité sulfatace. Při vybíjení / nabíjení na nich probíhá elektrochemický proces provázený změnou chemického složení aktivní hmoty elektrod s uvolňováním / absorpcí vody v elektrolytu (kyselina sírová).
To vysvětluje zvýšení měrné hmotnosti elektrolytu při nabíjení a snížení při vybití baterie. Jinými slovy, hodnota hustoty umožňuje posoudit elektrický stav baterie. K jejímu měření se používá speciální zařízení – automobilový hustoměr.
Destilovaná voda, která je součástí elektrolytu kyselých baterií, se při záporných teplotách mění v pevné skupenství - led. Proto, aby se zabránilo zamrznutí autobaterií v chladném počasí, je nutné použít zvláštní opatření stanovená v pravidlech pro vykořisťování.
Jaké typy baterií existují?
Moderní výroba pro různé účely produkuje více než tři desítky výrobků s různým složením elektrod a elektrolytu. 12 známých modelů běží pouze na lithium.

Jako elektrodový kov lze nalézt následující:
-
Vést;
-
žehlička;
-
lithium;
-
titan;
-
kobalt;
-
kadmium;
-
nikl;
-
zinek;
-
stříbrný;
-
vanadium;
-
hliník
-
některé další položky.
Ovlivňují elektrické výstupní charakteristiky a tím i aplikaci.
Schopnost odolávat krátkodobému vysokému zatížení vyplývajícímu z otáčení klikových hřídelí spalovacích motorů elektrickými startéry je charakteristická pro olověné akumulátory. Jsou široce používány v dopravě, nepřerušitelných zdrojích energie a nouzových napájecích systémech.
Standard galvanické články (běžné baterie) jsou obvykle nahrazovány nikl-kadmiovými, nikl-zinkovými a nikl-metal hydridovými bateriemi.
Ale lithium-iontové nebo lithium-polymerové konstrukce fungují spolehlivě v mobilních a počítačových zařízeních, stavebních nástrojích a dokonce i v elektrických vozidlech.
Podle typu použitého elektrolytu jsou baterie:
-
kyselý
-
zásadité.
Existuje klasifikace baterií podle účelu. V moderních podmínkách se například objevila zařízení, která slouží k přenosu energie — dobíjení jiných zdrojů. Takzvaná externí baterie pomáhá majitelům mnoha mobilních zařízení při absenci střídavé elektrické sítě. Je schopen opakovaně nabíjet tablet, smartphone, mobilní telefon.
Všechny tyto baterie mají stejný princip činnosti a podobné zařízení. Například model lithium-iontového prstu zobrazený na obrázku níže v mnoha ohledech opakuje konstrukci kyselých baterií, o kterých jsme hovořili dříve.
Zde vidíme stejné kontaktní elektrody, desky, separátor a pouzdro. Pouze jsou vyrobeny s ohledem na jiné pracovní podmínky.
Základní elektrické vlastnosti baterie
Provoz zařízení je ovlivněn parametry:
-
kapacita;
-
hustota energie;
-
samovybíjení;
-
teplotní režim.
Kapacita se nazývá maximální nabití baterie, které je schopna dát při vybíjení na nejnižší napětí. Vyjadřuje se v pendantech (systém SI) a ampérhodinách (nesystémová jednotka).
Jako typ kapacity existuje «energetická kapacita», která určuje energii uvolněnou během vybíjení na minimální povolené napětí. Měří se v joulech (SI) a watthodinách (nejednotky SI).
Hustota energie vyjádřená jako poměr množství energie k hmotnosti nebo objemu baterie.
Samovybíjení zvažte ztrátu kapacity po nabití při absenci zátěže na svorkách. To závisí na konstrukci a je umocněno porušením izolace mezi elektrodami z mnoha důvodů.
Provozní teplota ovlivňuje elektrické vlastnosti a v případě závažných odchylek od normy udávané výrobcem může dojít k poškození baterie. Teplo a chlad jsou nepřípustné, ovlivňují průběh chemických reakcí a tlak prostředí uvnitř boxu.
