Zdroje elektrického proudu
Elektrický proud — Jak jej vytvořit a udržovat
 Uspořádaný pohyb nabitých částic se nazývá elektrický proud. Abyste dostali elektrický proud do drátu, musíte v něm vytvořit elektrické pole. Pokud je nabité těleso spojeno vodičem se zemí, pak v vodiči vzniká krátkodobý elektrický proud. K získání a udržení elektrického pole v drátu použijte zdroje elektrického proudu.
Uspořádaný pohyb nabitých částic se nazývá elektrický proud. Abyste dostali elektrický proud do drátu, musíte v něm vytvořit elektrické pole. Pokud je nabité těleso spojeno vodičem se zemí, pak v vodiči vzniká krátkodobý elektrický proud. K získání a udržení elektrického pole v drátu použijte zdroje elektrického proudu.
V každém zdroji proudu se pracuje na oddělení kladně a záporně nabitých částic. Oddělené částice se hromadí na pólech zdroje. Mezi póly vzniká elektrické pole. Pokud je spojíte drátem, pak pole vzniká v drátu.
V elektrickém stroji se oddělování nábojů děje pomocí mechanické energie. Zároveň se stává elektrickým. V termočlánku se vnitřní energie přeměňuje na elektrickou energii. Jaderné baterie přeměňují atomovou energii na elektřinu.
Fotočlánek přeměňuje světelnou energii na elektrickou energii. Solární články se skládají z fotočlánků.Používají se tam, kde je světelná energie nejsnáze dostupná.
Energie řek, uhlí, ropy a atomů se v elektrárnách přeměňuje na elektrickou energii. Nejběžnějšími zdroji elektrického proudu jsou galvanické články a baterie.
Galvanické články
Galvanický článek je zdroj proudu, ve kterém se chemická energie přeměňuje na elektrickou energii.
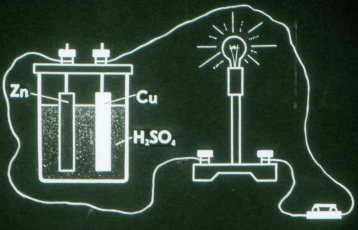
Takto funguje nejjednodušší galvanický článek.
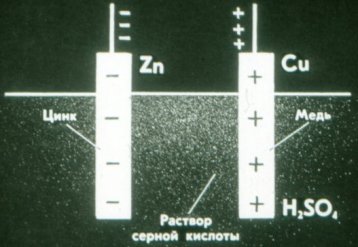
První elektrochemický článek vynalezl Volt v roce 1799. Z jednotlivých prvků sestrojil baterii, kterou nazval „voltový sloup“. V galvanickém článku musí elektrody nutně interagovat s roztokem různými způsoby, a proto jsou elektrody vyrobeny z různých materiálů.

Zinková deska v článku Volta je nabitá záporně a měděná deska je nabitá kladně.
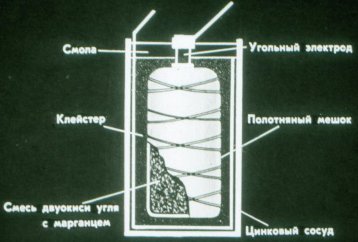
A takto funguje suchý galvanický článek. Místo kapaliny používá hustou pastu:
Baterie se může skládat z několika prvků:

Žárovky v elektrických lampách, ale i různé další přenosné elektrospotřebiče a dětské hračky jsou napájeny galvanickými články. Po vypotřebování elektrod v galvanickém článku je článek vyměněn za nový.
Baterie
Baterie jsou chemické zdroje elektrického proudu, ve kterých nedochází ke spotřebě elektrod. Nejjednodušší baterii tvoří dvě olověné destičky ponořené do roztoku kyseliny sírové.
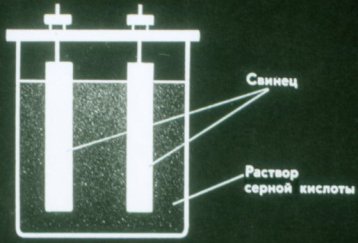
Taková baterie stále nedodává proud. Před použitím se musí nabít. K tomu připojte póly baterie ke stejným pólům každého zdroje proudu.
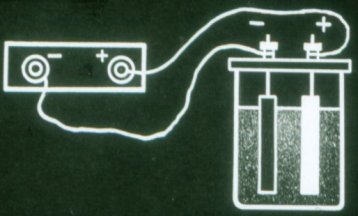
Proud, který protéká baterií během nabíjení, mění chemické složení jejích desek. Chemická energie baterie se zvyšuje.
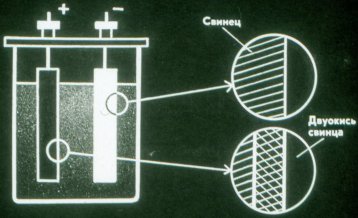
Když se baterie vybije, přemění chemickou energii na elektrickou energii. Vybitou baterii lze dobít.
Baterie se shromažďují ze samostatných baterií.
Kromě kyselých (olověných) baterií se používají alkalické (železo-niklové) baterie.
Nikl-železná baterie:
Dnes jsou široce používány také nikl-kadmiové a nikl-metalhydridové baterie. Stříbrno-zinkové baterie se používají v letectví a vesmíru Nové typy baterií: lithium-iontové, lithium-polymerové se používají v mobilních telefonech, tabletech a dalších moderních přenosných zařízeních.
Baterie se používají v případech, kdy je výhodnější zdroj elektrického proudu dobíjet než vyměnit za nový. V autě se baterie používá ke spouštění motoru a provozu různých zařízení. Ve vesmíru se baterie dobíjí solárními panely. Při vybití napájí rádiové vysílače a zařízení.
Viz také: Baterie. Příklady výpočtů

